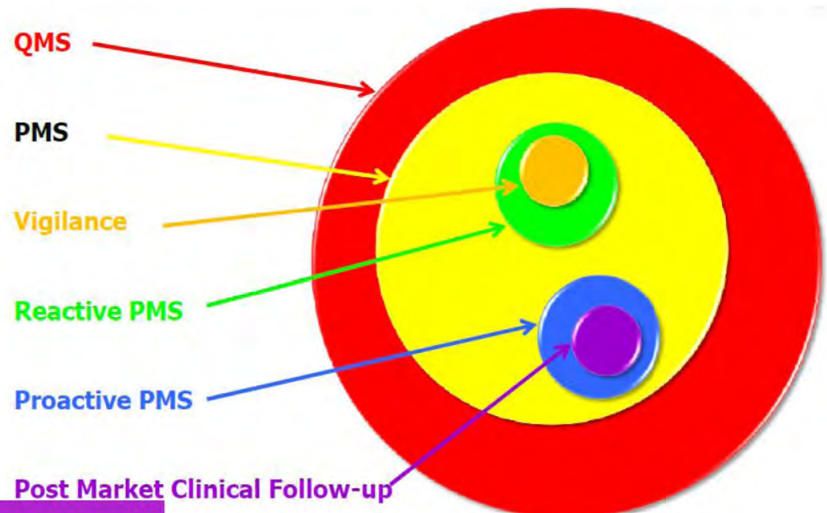
소프트웨어 의료기기 (SaMD) 위험관리 방법
소프트웨어의 사용목적 및 안전성 관련 특성 식별
소프트웨어의 사용목적과 적용 범위를 명확히 정의해야 합니다.
소프트웨어가 사용목적을 달성하는 데 어떠한 역할을 하는지 파악해야 합니다.
이를 통해 필요한 소프트웨어의 기능적 특성을 식별하고, 이들 중 안전성에 영향을 미치는 요소를 파악해야 합니다.
위해요인 분석
제조자는 위험관리 프로세스에 따라 정상 및 고장 상태에서 발생 가능한 위해요인을 분석해야 합니다.
오작동, 측정 오류, 과도한 출력, 데이터 손실 등이 발생할 수 있는 위해요인을 파악하고 이에 대한 대책을 마련해야 합니다.
소프트웨어의 사용목적과 적용범위를 명확히 하여 이를 달성하기 위한 소프트웨어의 역할을 정확히 이해하고 위해요인을 분석하는 것이 중요합니다.
'디지털의료제품 > IEC 62304' 카테고리의 다른 글
| 인공지능 의료기기 임상시험을 위한 참조표준 구축 방안 (0) | 2022.04.16 |
|---|---|
| 스캔 이미지를 분석하는 인공지능 의료기기의 성능 확인 시험 규격 (0) | 2022.04.09 |
| 소프트웨어 의료기기 형상 관리(Configuration Management) (0) | 2022.04.09 |
| 서버 및 클라우드 환경이 달라지면 소프트웨어 의료기기 동등품목에 차이가 있나요? (0) | 2022.03.07 |
| 의료기기 소프트웨어의 밸리데이션 (화이트박스와 블랙박스 접근법) (0) | 2021.11.05 |