PMS와 PMCF 차이
해외인증/EU MDR2021. 9. 11. 08:30
728x90
반응형
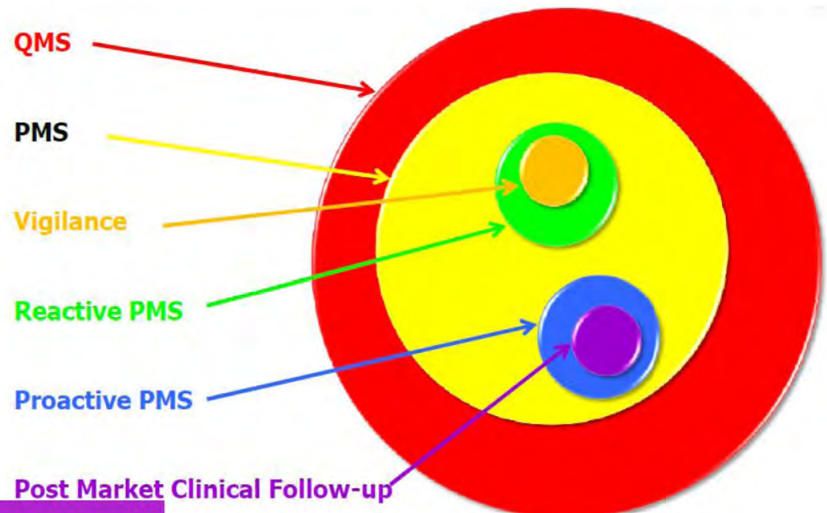
1. 시판 후 관리 (PMS: Post-Market Surveillance)
유럽 시장에서 의료기기의 시판 후 관리는 모든 의료기기에 대해 필수적인 과정입니다. 이 관리 과정은 유럽 내 출시된 제품의 시장 상황을 지속적으로 모니터링하는 것을 목적으로 합니다.
모니터링 방법: 자사 제품뿐만 아니라 유사 제품들을 포함한 시장의 다양한 요소들을 모니터링합니다. 이는 시장 동향, 제품의 성능, 안전성, 그리고 소비자의 피드백을 포괄합니다.
2. 시판 후 임상 추적 (PMCF: Post-Market Clinical Follow-up)
PMCF는 PMS의 중요한 부분으로, 제품의 임상적 안전성과 성능을 지속적으로 평가하기 위한 활동입니다.
가. PMCF Study
이는 실제 임상 환경에서 자사 제품의 사용을 추적하는 것을 의미합니다.
허가 전 임상과 거의 동등한 수준의 정밀한 데이터 수집 및 평가를 포함합니다.
제품이 실제 사용 환경에서 어떻게 작동하는지, 장기적인 효과와 안전성을 평가하기 위해 수행됩니다.
나. PMCF Survey
제품 사용 후 전문가, 의사, 환자로부터 수집하는 설문조사를 포함합니다.
이 설문조사는 제품의 사용성, 효과, 부작용 등에 대한 직접적인 피드백을 제공합니다.
728x90
반응형
'해외인증 > EU MDR' 카테고리의 다른 글
| EU MDR 사후심사 중점 체크포인트 4가지 (0) | 2022.01.05 |
|---|---|
| EU MDR 인체 이식형 의료기기 요구사항 (0) | 2021.10.25 |
| EU MDR 규제 준수 책임자(PRRC)의 역할 및 책임 5가지 (0) | 2021.08.17 |
| EU MDD 대비 MDR 주요 변경사항 10가지 (0) | 2021.03.13 |
| PMS와 PSUR 차이 비교 (0) | 2021.03.12 |
댓글()








